浙江省中藥配方顆粒質量標準制定規程(試行)
為落實《國家藥監局國家中醫藥局國家衛生健康委國家醫保局關于結束中藥配方顆粒試點工作的公告》(2021年第22號)要求,加強浙江省中藥配方顆粒質量標準管理,省局組織制定了《浙江省中藥配方顆粒質量標準制定規程》(試行),現予發布。本規程自發布之日起施行,對施行中遇到的相關問題,請及時反饋省局。
特此通告。
浙江省藥品監督管理局
2021年8月16日
浙江省中藥配方顆粒質量標準制定規程(試行)
為加強浙江省中藥配方顆粒質量標準的管理,規范中藥配方顆粒質量標準研究、申報和制定工作,根據《中華人民共和國藥品管理法》、《國家藥監局國家中醫藥局國家衛生健康委國家醫保局關于結束中藥配方顆粒試點工作的公告》(2021年第22號)、《國家藥監局關于發布<中藥配方顆粒質量控制與標準制定技術要求>的通告》(2021年第16號)(以下簡稱2021年第16號通告)、《國家藥典委員會有關中藥配方顆粒藥品標準制定的通知》等要求,結合本省實際,制定本規程。
一、適用范圍
(一)申報單位
鼓勵本省轄區藥品生產企業申報或與有中藥配方顆粒研究基礎的單位聯合申報。
(二)品種范圍
1.中藥配方顆粒品種應符合國家藥監局2021年第16號通告要求。
2.中藥配方顆粒原則上應為現行版《中國藥典》等國家藥品標準或《浙江省中藥材標準》《浙江省中藥炮制規范》等收載品種制成。
3.中藥配方顆粒國家標準已頒布的,不再收載。
二、工作程序
(一)立項
申報單位向省食品藥品檢驗研究院(以下簡稱食藥檢院)
提交中藥配方顆粒質量標準研究立項申請,提交申報表、質量標準草案(一式一份)。食藥檢院收到資料后5日內按照適用范圍要求對立項資料進行形式審查,并將立項申請的基本信息及形式審查結果在食藥檢院網站上公示。目前我省科研立項已開展中藥配方顆粒質量標準研究的品種詳見附件1。
(二)標準申報
申報單位按照國家藥監局2021年第16號通告要求開展標準研究,按本程序申報資料要求(詳見附件2)整理申報資料,向食藥檢院提出申請,并提交申報資料(含兩份紙質版和一套電子版)。
食藥檢院對資料進行形式審查,資料齊全、規范的,予以接收,并開具標準復核檢驗送樣單(除已完成標準復核檢驗的品種外)。必要時,可組織對標準研究現場進行核查。
(三)復核檢驗
申報單位憑標準復核檢驗送樣單,送至少三批樣品、必要的其他樣品、申報資料至食藥檢院指定的藥品檢驗機構。藥品檢驗機構收到申報資料和樣品后,50日內完成標準復核及樣品檢驗。
(四)技術審核
食藥檢院40日內組織專家對申報資料進行技術審核。經審核,對需要補充研究的,食藥檢院原則上提出一次補充資料要求,列明全部問題、補充要求和時限,以書面方式通知申報單位。申報單位一次性按要求提交全部補充資料,補充資料時間不計入技術審核時限;逾期提交的,視為自動放棄標準申報。通過審核的標準,食藥檢院將申報表、中藥配方顆粒質量標準、審核意見報省局。
(五)標準公示
省局將中藥配方顆粒質量標準在省局政務網上公示征求意見,公示時間不少于15日。食藥檢院根據征求意見完善標準,并將中藥配方顆粒質量標準正文及其編制說明報省局。
(六)核準發布
省局進行合規性審核,審核通過后以通告形式發布并在省局政務網上公開。
(七)標準備案
標準發布后30日內,省局將標準發布文件、標準文本、編制說明報國家藥典委員會備案。
三、標準管理
(一)本省頒布的每個中藥配方顆粒質量標準賦予一個標準編號,標準編號格式為:浙PF+四位順序號+四位年號。標準變更的,在首次標準編號后加四位變更年號。
(二)本省中藥配方顆粒質量標準頒布實施后,標準申報單位、使用單位應當定期進行標準適用性評估,根據評估情況及時提出修訂標準。
(三)中藥配方顆粒國家標準頒布實施后,本省相應的中藥配方顆粒質量標準廢止。除特殊情況外,給予6個月的執行標準過渡期。
(四)對不適合繼續收載或不符合收載范圍的中藥配方顆粒質量標準,經評估,省局發文廢止。
(五)食藥檢院應當建立標準技術審核的管理體系和中藥配方顆粒專家庫,完善相關工作制度,依法依技術要求開展審核,確保審核結果科學、公平、公正。
附件:1.本省科研立項已開展研究的中藥配方顆粒品種名單
2.申報資料目錄及要求
3.中藥配方顆粒質量標準申報表
4.基本情況撰寫要求
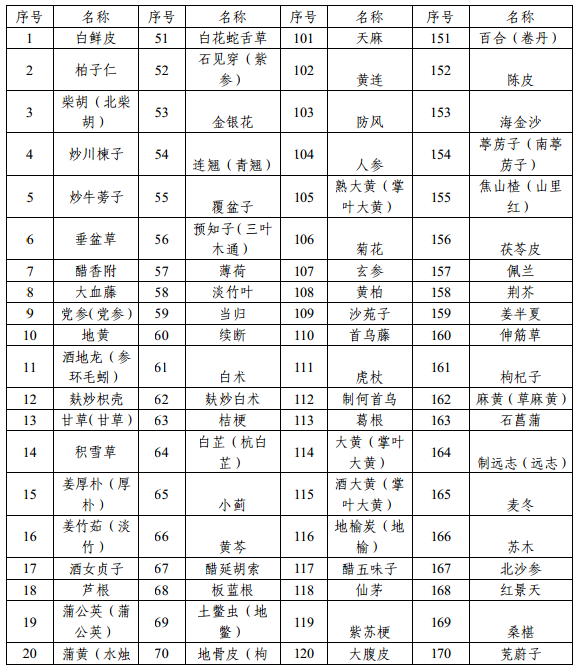
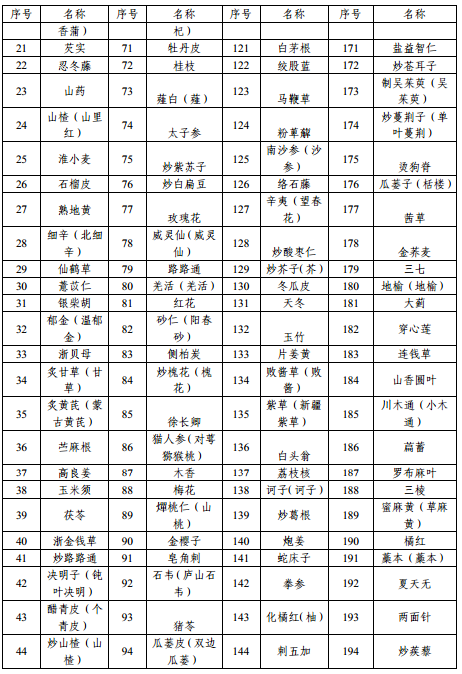
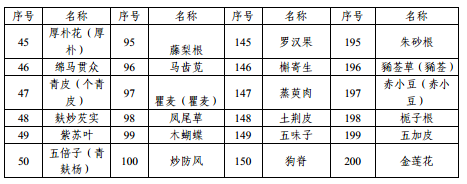
附件1 本省科研立項已開展研究的中藥配方顆粒品種名單
附件2 申報資料目錄及要求
資料一、中藥配方顆粒質量標準申報表
資料二、研究資料部分
資料1.基本情況
資料2.原料研究資料
資料3.輔料研究資料
資料4.標準湯劑研究資料
資料5.生產工藝研究資料
資料6.與質量相關的研究資料
資料7.質量標準研究資料
資料8.穩定性研究資料
資料9.樣品檢驗報告書
資料10.藥包材研究資料
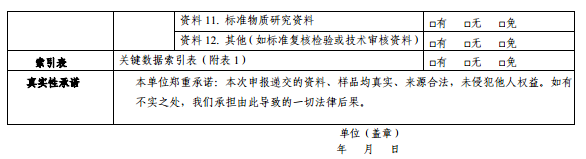
資料11.標準物質研究資料
資料12.其他(如標準復核檢驗或技術審核資料)
編制要求如下:
資料一、申報表按附件3編制。
資料二、研究資料部分按以下要求編制。
資料1按附件4撰寫。
資料2-10按照國家藥典委員會《有關中藥配方顆粒藥品標準制定的通知》附件1中藥配方顆粒國家標準申報資料目錄及要求進行整理。
資料11列明上述研究中使用標準物質的名稱、生產單位、說明書、批號等信息。
中藥配方顆粒質量標準中使用的標準物質,如使用非國家藥品標準物質的,申請標準復核(或審核)時,還應參照國家藥品標準物質研制技術要求,提供新增標準物質研制、標定等資料和實物樣品。
資料12復核資料按《國家藥監局關于發布<中藥配方顆粒質量控制與標準制定技術要求>的通告》(2021年第16號)》中“標準復核技術要求”提供。
附件3中藥配方顆粒質量標準申報表

附件4 基本情況撰寫要求
一、概況
簡述企業基本情況、中藥配方顆粒研究總體情況、申報單位成品配方顆粒的生產與銷售歷史、同品種的國家標準或地方標準發布情況、標準復核檢驗及技術審核情況、相關專利等。
二、證明文件
提供以下資料:
(一)多家企業聯合申報的,提供合作研究協議復印件以及相關研究項目責任分工。
(二)申報單位營業執照、《藥品生產許可證》及其變更的批件復印件(如生產場地、生產單位等)。
(三)輔料、包裝材料執行標準復印件、登記證明。
(四)非本省的中藥配方顆粒質量標準頒布文件、標準正文、起草說明及備案證明復印件(如有)。
三、研究資料綜述
(一)原輔料研究情況
1.原料研究資料
1.1中藥材
簡述基本情況,包括:
(1)道地產區與主產區情況,自建種植(養殖)基地情況。
(2)中藥材標準收載的植物來源,包括基源情況。
(3)研究用中藥材樣品情況,包括基源、藥用部位、采收、產地加工、產地(地級市)、批次數量、貯藏方法等。
1.2飲片
簡述炮制方法及工藝參數、執行標準等。
1.3內控標準
(1)簡述藥材/飲片內控標準是否高于法定標準要求,如增加了檢測項目或制定了嚴于法定標準的檢測限度,簡述新增項目或限度研究基本情況。
(2)簡述安全性指標研究情況。
2.輔料研究資料
2.1輔料來源
簡述輔料名稱、級別、用途、生產企業、登記號等。
2.2輔料質量標準
簡述輔料執行標準及標準號。
(二)標準湯劑研究情況
1.制備工藝
簡述制備方法,如飲片前處理、每煎飲片量、浸泡時間、煎煮次數、加水量、煎煮時間、濃縮方法和溫度、干燥方法等。涉及提取揮發油的,還應說明提取方法和提取量或提取時間等。
2.參數表征
2.1出膏率
以表格形式列出各批次標準湯浸膏得率及標準偏差,表述均值加減3倍SD(或均值的70%—130%)出膏率的允許范圍,評價標準湯出膏率實測值。
2.2有效(或指標)成份的含量及含量轉移率簡述測定方法及測定指標,以表格形式列舉測得各批次標準湯劑中有效(或指標)成份的含量,計算轉移率和標準偏差。表述轉移率均值加減3倍SD(或均值的70%—130%)數值,及相應有效(或指標)成份的含量范圍。
2.3特征圖譜/指紋圖譜
簡述采用的方法、確定指紋峰個數及其依據、判定標準(如
相對保留時間、相似度等)等。
(三)配方顆粒研究情況
1.生產工藝研究
1.1生產工藝概述
(1)簡述處方(飲片名、投料量)、前處理(如切制、破碎等)、提取方法、溫度、加水量、提取次數、濃縮方法(包括溫度、真空度等)、輔料組成(包括種類及用量)、制成總量及規格。如濃縮、干燥中加入輔料的,簡述加入輔料種類和用量范圍。
(2)簡述成型工藝研究內容,包括輔料選擇、處方篩選、制粒方法、干燥方法、技術參數、包裝材料等;簡述輔料與中間體(以干燥品計)的比值。
1.2中間體研究
(1)中間體出膏率實測值與標準湯劑出膏率對比研究結果。
(2)中間體有效(或指標)成份的含量與標準湯劑對比研究結果。
(3)中間體特征圖譜/指紋圖譜與標準湯劑對比研究結果。
(4)中間體內控標準項目簡述。
(5)中間體中含輔料的,簡述中間體中輔料種類、用量。
1.3生產試驗研究
簡述至少3批以上生產規模試驗或驗證批次數據,評價得膏率、含量指標、特征圖譜/指紋圖譜與標準湯的一致性。
1.4量值傳遞
以出膏率、含量及含量轉移率、指紋圖譜或特征圖譜、浸出物等的值為表征,簡述生產全過程的量值傳遞情況,設定可接受的偏差范圍及理由,從原料到中間體到成品生產全過程的量值傳遞應具相關性、可行性和合理性。
2.質量標準研究
簡述成品質量標準控制項目、方法和方法學驗證結果,說明擬定限度的依據,分析設定的質控項目、限度與原輔料、工藝及穩定性之間的關系,與安全性及有效性的聯系。
3.穩定性試驗
簡述穩定性考察方法及結果。
4.樣品檢驗
簡述自檢報告與標準復核檢驗報告情況。如存在差異的,分析原因。
5.直接接觸藥品的包裝材料和容器
提供直接接觸藥品的包裝材料和容器的執行標準、生產企業、登記號等。
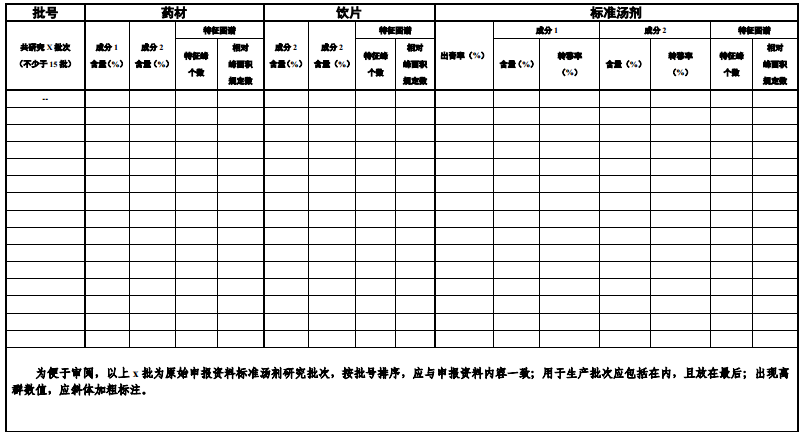
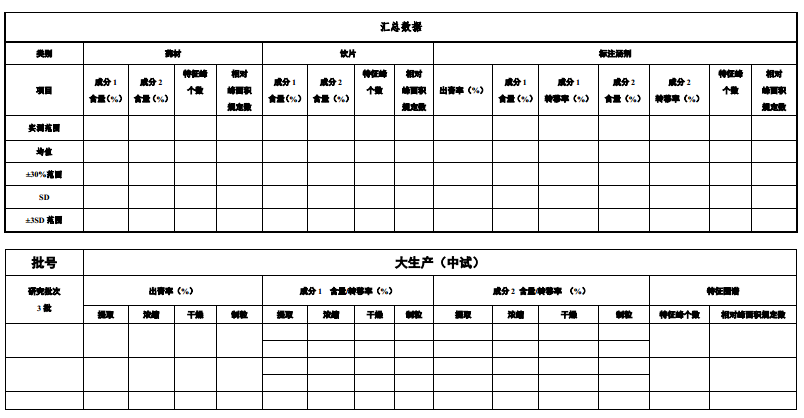
6.匯總量質傳遞數據表(見附表2)
附表1 關鍵數據索引表



附表2 量質傳遞數據匯總表
(參考:《中國藥典》2020年版,某飲片規定成分1不得少于..%;成分2不得少于..%,
,有效數位同標準限度)
?
【大宗商品公式定價原理】
生意社基準價是基于價格大數據與生意社價格模型產生的交易指導價,又稱生意社價格。可用于確定以下兩種需求的交易結算價:1、指定日期的結算價
2、指定周期的平均結算價
定價公式:結算價 = 生意社基準價×K+C
K:調整系數,包括賬期成本等因素。
C:升貼水,包括物流成本、品牌價差、區域價差等因素。
(文章來源:浙江省藥品監督管理局)
現貨通
詳情>>
把握現貨走勢,就用生意社現貨通!
1.五檔位置法
2.k柱圖法
3.均線穿越法
4.超級分析師(PriceSeek)
期現通
詳情>>
關注基差變化,把握投資機會!
1.現貨價格走勢
2.期貨價格走勢
3.基差價格走勢
股票通
詳情>>
買賣周期股,就用生意社股票通!
1.商品價格影響企業利潤
2.500+個商品價格漲跌幅度
3.1000+只周期股


生意社商品站
企業動態
- 連翹商品報價動態(2024-06-07)
- 06-07
- 麥冬商品報價動態(2024-06-07)
- 06-07
- 黃芪商品報價動態(2024-06-07)
- 06-07
- 三七商品報價動態(2024-06-07)
- 06-07
- 當歸商品報價動態(2024-06-07)
- 06-07
- 枸杞商品報價動態(2024-06-07)
- 06-07
- 金銀花商品報價動態(2024-06-07)
- 06-07
- 黨參商品報價動態(2024-06-07)
- 06-07
國內動態
- 6月14日生意社連翹基準價為98.75元/公斤
- 06-14
- 6月14日生意社麥冬基準價為134.00元/公斤
- 06-14
- 6月14日生意社枸杞基準價為45.50元/公斤
- 06-14
- 6月14日生意社黃芪基準價為23.60元/公斤
- 06-14
- 6月14日生意社三七基準價為133.00元/公斤
- 06-14
- 6月14日生意社黨參基準價為137.60元/公斤
- 06-14
- 6月14日生意社當歸基準價為114.00元/公斤
- 06-14
國際動態
- 中國枸杞輸歐盟破壁克壘取得新突破
- 06-23
- 連花清瘟海外版圖擴大 獲肯尼亞注冊批文
- 03-17
- 羅馬尼亞千家農戶種植中國枸杞
- 02-07
- 美國草藥藥典《枸杞子》中文版出版
- 02-03
- 韓國對中國產山茱萸和枸杞實施召回
- 12-04
- 連花清瘟獲毛里求斯“中成藥”注冊批文
- 09-22

 浙公網安備 33010002000024號
浙公網安備 33010002000024號